[뉴스락] SK바이오팜이 개발한 뇌전증 신약 ‘세노바메이트(Cenobamate)'의 미국 식품의약국(FDA) 허가 가능성이 높아졌다.
세노바메이트는 미국에서 임상3상을 완료하고 지난 2월 FDA에 신약허가를 신청한 약물로 오는 21일 최종 결과가 발표될 예정이다.
18일 김태희 미래에셋대우 연구원에 따르면 이번 임상 결과는 세노바이트의 임상2상에 대한 내용이며, 통제되지 않는 부분발작에 대해 유효성과 안전성, 내약성 등을 확인하기 위한 실험이다.
임상결과 1~3개의 뇌전증 치료제를 복용해도 부분발작을 일으키는 환자 437명 대상으로 위약과 세노바메이트 △100mg △200mg △400mg를 투여했을 때, 부분발작 빈도가 유의미하게 감소했다.
일반적으로 임상3상은 유효성을 평가하는데 세노바메이트의 임상3은 유효성이 아닌 안정성을 확인하는 오픈라벨 시험으로 이루어졌다.
김 연구원은 “임상2상에서의 우수한 효능을 FDA가 인정해 임상3상에서 유효성 평가를 면제해주었기 때문이다”며 “임상 결과의 학술지 게재로 세노바메이트의 성공 가능성은 한층 높아졌다는 판단이다”고 밝혔다.
기존 약물 대비 경쟁력도 높은 것으로 알려졌다.
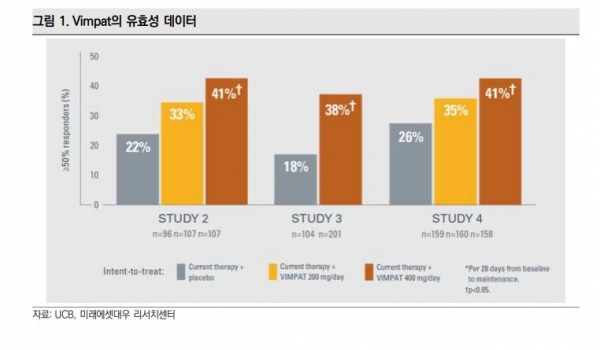
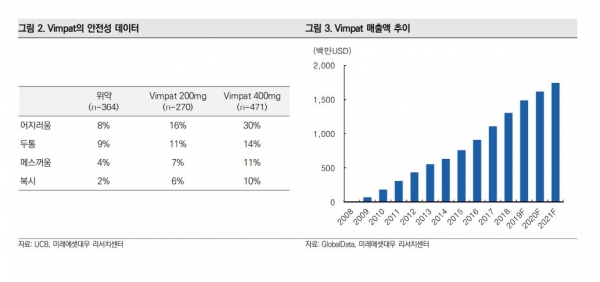
뇌전증 치료제의 대표 약물은 UCB사의 빔팻(VIMFAT)이다. 빔팻은 지난해 매출액 13억달러를 기록했으며, GlobalData에 따르면 2021년 매출액은 17억4000만달러를 기록할 것으로 예상된다.
세노바메이트와 빔팻은 단순 비교 할 수 없지만 빔팻의 임상2/3상 데이터 기준으로 세노바메이트의 약효가 비교우위에 있음을 확인할 수 있다.
각 약물의 고용량군을 기준으로 부분발작의 50%이상 감소 비율을 보면 빔팻은 38~41%임에 반해 세노바메이트는 64%였다.
세노바메이트는 지난주 국제학술지 란셋 뉴롤로지(Lancet Neurology)에 게재됐다.
란셋 뉴롤로지에 발표된 자료에 따르면 용량이 증가할수록 임상 중단 환자 비율이 높아지긴 했지만 이상 반응이 졸림과 어지러움, 두통 등으로 치명적이지 않다.
김 연구원은 “이번 임상3상 결과에서 특별한 부작용 이슈만 없다면 오는 21일 FDA 최종 허가는 가능할 전망”이라고 전했다.
이어 “세노바메이트가 출시되면 국내 업체가 개발한 신약 중 처음으로 선진 시장에서 의미 있는 매출액을 기록할 것으로 예상한다”고 전망했다.
또한, 최근 연이은 임상3상 실패로 투자심리가 위축된 현 상황에 온기를 불어넣을수 있는 이벤트가 될것으로 내다봤다.
SK바이오팜은 지난달 25일 한국거래소에 상장을 위한 예비심사 신청서를 제출했다.
김 연구원은 “세노바이트와 이미 미국 시장에 출시한 수면장애치료제 수노시(Sunosi, Jazz Pharmaceutical 판매), 코스피 상장에 따른 긍정적인 수급 효과가 예상되는 SK바이오팜에 주목할 필요가 있다”고 설명했다.


